根据《中华人民共和国食品安全法》《保健食品原料目录与保健功能目录管理办法》等规定,11月23日,国家市场监督管理总局会同国家卫生健康委员会、国家中医药管理局制定了辅酶Q10等五种保健食品原料目录,现予发布,自2021年3月1日起施行。
历时多年,经过多轮征求意见,辅酶Q10、破壁灵芝孢子粉、螺旋藻、鱼油、褪黑素这5种原料今天“转正”了,列入保健食品原料目录。
2020年3月1日起,企业无需支付高昂的费用,也无需忍受漫长的注册流程,可以短平快地备案以辅酶Q10、破壁灵芝孢子粉、螺旋藻、鱼油、褪黑素为主要原料的保健食品了。
瑞欧科技就5种原料的要求进行了总结:
|
原料名称 |
每日用量 |
功效 |
|||
|
名称 |
用量范围 |
适宜人群 |
不适宜人群 |
注意事项 |
|
|
辅酶Q10 |
30-50mg |
成人 |
少年儿童、孕妇、乳母、过敏体质人群 |
服用治疗药物的人群食用本品时应向医生咨询 |
增强免疫力 抗氧化 |
|
破壁灵芝孢子粉 |
1-4g |
免疫力低下者 |
少年儿童、孕妇及乳母 |
|
增强 免疫力 |
|
螺旋藻 |
3-4g |
免疫力低下者 |
婴幼儿、孕妇及乳母、过敏体质人群 |
|
增强 免疫力 |
|
鱼油
|
不高于4.0g (其中,EPA+DHA的用量不低于1.0g) |
血脂偏高者 |
少年儿童、孕妇、乳母;出血倾向者和出血性疾病患者;肝功能不全者 |
对海产品过敏者不推荐食用 |
辅助降血脂 |
|
褪黑素 |
1-3mg |
成人 |
少年儿童、孕妇、乳母 |
从事驾驶、机械作业或危险操作者,不要在操作前或操作中食用。自身免疫症(类风湿等)及甲亢患者慎用。 |
改善睡眠 |
保健食品的备案和注册的区别
1、保健食品备案和注册范围
哪些保健食品需要申请保健食品备案?
(1)使用的原料已经列入保健食品原料目录的保健食品。
(2)首次进口的属于补充维生素、矿物质等营养物质的保健食品。(其营养物质应当是列入保健食品原料目录的物质)
2、备案产品可用的原辅料及产品剂型
备案产品可用的原料
目前营养素补充剂产品支持复配原料,而功能性原料仅支持单方原料(除褪黑素可复配维生素B6)。
*参考法规:
1、营养素补充剂产品原料目录
《保健食品原料目录 营养素补充剂》。
该目录包含了:23种维生素和矿物质(钙、镁、钾、锰、铁、锌、硒、铜、维生素A、维生素D、维生素B1、维生素B2、维生素B6、维生素B12、烟酸、叶酸、生物素、胆碱、维生素C、维生素K、泛酸、维生素E、β-胡萝卜素)。
2、功能性产品原料目录
1.《保健食品原料目录 辅酶Q10》
2.《保健食品原料目录 破壁灵芝孢子粉》
3.《保健食品原料目录 螺旋藻》
4.《保健食品原料目录 鱼油》
5.《保健食品原料目录 褪黑素》
备案产品可用的辅料
参考法规:《保健食品备案产品可用辅料及其使用规定(2019年版)》。该目录包含了196种辅料。
产品剂型
片剂(片,含片,咀嚼片,泡腾片)、口服溶液剂(口服液,滴剂)、胶囊(硬胶囊,软胶囊)、颗粒(颗粒)。
3.保健食品备案流程
进口保健食品备案材料清单 取得备案账号的申请材料 1.境外生产厂商的资质证明文件 2.联系人委托授权书 申请备案凭证的申请材料 1.进口保健食品备案登记表以及备案人对提交材料真实性负责的法律责任承诺 2.备案人主体登记证明文件复印件 3.产品配方材料:产品配方表(配方发生改变的原注册人需要提交调整后的配方及配方发生改变的说明) 4.产品生产工艺材料,包括生产工艺简图及说明 5.安全性和保健功能评价材料 5.1三批中试以上规模工艺生产的产品功效成分或标志性成分、卫生学、稳定性检验报告(原注册人的产品配方没有发生改变的不需要提供此项) 5.2原料、辅料合理使用的说明,及标签说明书、产品技术要求制定符合相关法规的说明 6.直接接触保健食品的包装材料种类、名称、相关标准 7.产品标签说明书样稿 8.产品技术要求材料 9.具有合法资质的检验机构出具的符合产品技术要求全项目检验报告 9.1食品检验机构的资质证明文件 9.2三批符合产品技术要求的全项目检验报告 10.产品名称相关检索材料 11.其他表明产品安全性和保健功能的材料 12.产品生产国(地区)政府主管部门或者法律服务机构出具的备案人为上市保健食品境外生产厂商的资质证明文件 13.产品生产国(地区)政府主管部门或者法律服务机构出具的保健食品类似产品上市销售一年以上的证明文件,或者产品境外销售以及人群食用情况的安全性报告 14.产品生产国(地区)或者国际组织与保健食品相关的技术法规或者标准原文 15.产品生产国(地区)上市的包装、标签、说明书实样、中文译本及公证书 16.由境外备案人常驻中国代表机构办理备案事务的,应当提交《外国企业常驻中国代表机构登记证》及其复印件。境外备案人委托境内的代理机构办理备案事项的,应当提交经过公证的委托书原件以及受委托的代理机构营业执照复印件。 4.申请备案的时间和费用 目前申请备案凭证的时间一般为半年到一年。费用方面,试验是主要的支出项,其中包括卫生学试验、稳定性试验、功效成分试验等。此外,还会包括公证翻译费用。如果委托机构代理还会有相应的服务费用 信息来源:国家市场监督管理总局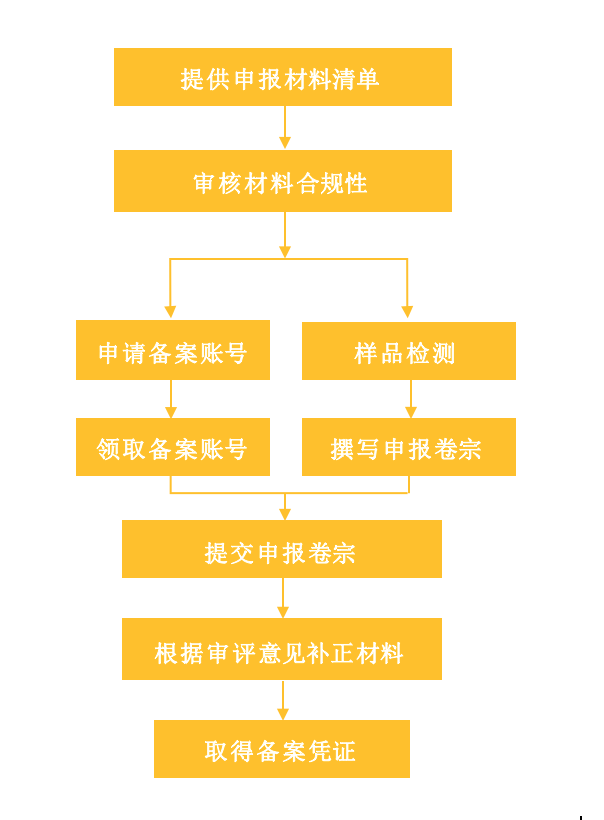





 化学品
化学品
 食品接触材料
食品接触材料
 化妆品
化妆品
 绿色双碳
绿色双碳
 境外农药登记
境外农药登记
 中国农药登记
中国农药登记